책임 있는 연구 개발
안전한 임상 연구
국제 윤리 규정 준수
SK바이오사이언스는 국제 윤리 규정에 따라 안전한 임상 연구를 진행하고 있습니다. 국제 임상시험 수행지침인 국제의약품규제조화위원회(ICH)1) 가이드라인 및 국내 임상시험 수행지침(KGCP)2)을 준수하며, 그 외 임상시험은 수행 국가별 규정에 따라 의약품 규제기관 등의 승인을 취득한 뒤 진행하고 있습니다. 또한 사람을 대상으로 한 의학 연구의 윤리적 원칙인 헬싱키 선언(Declaration of Helsinki)에 포함된 원칙을 준수하여 수행하고 있습니다.
- 1)ICH(International Council for Harmonisation): 국제의약품규제조화위원회
- 2)KGCP(Korean Good Clinical Practice): 국내 임상시험 수행지침
- 전임상
- 암성1상
- 암성2상
- 암성3상
- 허가
임상시험 안전성과 투명성 확보
SK바이오사이언스는 식품의약품안전처 및 각 수행 국가의 규정과 가이드라인을 철저히 준수함으로써 임상시험의 안전성을 보장합니다. 전임상 과정에서는 동물실험을 통해 독성 여부를 사전에 확인하며, 각 임상시험 단계별로 대상자의 안전성 및 백신의 유효성을 평가하고 있습니다.
당사는 임상허가에 관한 모든 자료를 취합하여 해당 규제기관에 제출하며, 특히 임상 과정에서의 중대한 이상반응 발생 시 보고서를 작성하여 각 규제기관에 보고함으로써 임상시험의 투명성을 보장합니다. 또한, 당사에서 수행되는 중재적 임상시험(Interventional studies)에 대한 정보는 임상시험 진행 현황에 따라 미국 국립의학도서관이 운영하는 임상시험 정보 사이트에 등록하여 공개하고 있습니다.
임상시험 다양성 추구
임상시험에서 참여자의 다양성은 제품 개발 및 성공뿐만 아니라 형평성 측면에서 중요한 요소로 작용합니다. SK바이오사이언스는 이러한 점을 인지하고 국내를 포함한 다양한 국가에서 글로벌 임상시험을 진행하며, 인종, 민족, 연령, 성별, 사회적 배경 등 다양한 특성을 가진 참여자로부터 데이터를 수집하고 있습니다. 당사의 대표 백신 중 하나인 스카이코비원는 한국뿐 아니라 동남아시아, 오세아니아, 유럽 지역에서 확보된 데이터를 기반으로 품목 허가를 받았습니다. 스카이코비원의 안전성 데이터를 바탕으로, 향후 개발될 후속 백신 또한 임상시험 시 국가 및 연령별 대표성을 고려한 참여자 다양성을 확보하고자 합니다.
임상시험 참여자 안전 및 Clinical Trial Practices
SK바이오사이언스는 모든 임상시험 참여자의 안전과 권리 보호를 위해 노력하고 있습니다. 참여자가 임상시험의 위험 및 이익에 대해 충분히 이해한 후 자발적인 동의 절차를 거쳐 참여하도록 하고 혈액샘플 수집은 별도의 인체유래물 연구 동의서를 통해 대상자에게 충분한 정보를 제공한 후 추가 동의를 받아 진행합니다.
또한, 임상시험 단계에서 발생할 수 있는 피해를 보상하기 위한 기준 및 절차를 수립하고, 자료 안전성 모니터링 위원회(DSMB)3) 운영을 통해 참여자를 위한 안전 장치를 마련하였습니다. 자료 안전성 모니터링 위원회는 자문을 담당하는 외부의 독립적인 전문가로 구성하여 임상시험 과정, 안전성 자료, 필요시 주요 유효성 결과 변수를 주기적으로 검토 및 평가하여 임상시험의 지속, 변경 또는 중지 여부에 대한 자문을 담당하고 있습니다. 위원회는 임상시험 참여자의 위험 및 이익의 균형을 판단하여 조기 종료 여부를 결정하는 등 참여자의 안전과 권리 보호에 핵심적인 역할을 수행하고 있습니다.
임상시험 운영 과정에서도 각 임상 단계에서 참여자의 안전성 검토를 완료한 후 다음 단계로 이동할 수 있는 조치를 취하였습니다. 또한 후속 모니터링 기간을 1년으로 설정하는 등 국제 기준보다 강화된 절차로 운영하고 있습니다.
- 3)DSMB(Data Safety Monitoring Boards): 자료 안전성 모니터링 위원회
임상시험 품질 강화
임상 감사
SK바이오사이언스는 임상시험이 윤리 원칙 및 기준 사항에 따라 수행되고 있는지를 확인하기 위해 임상 감사를 진행하고 있습니다. 당사가 감사를 통해 준수 여부를 확인하는 윤리 원칙 및 기준은 임상시험계획서(Protocol)와 당사의 SOP 등의 내부 규정, 임상시험관리기준(GCP)1) 및 관련 규정, ICH 가이드라인, 임상시험위원회(IRB)2)의 규정 및 헬싱키 선언 등 국내외 주요 관련 기준들입니다.
Development QM팀은 독립적으로 감사를 수행하여 객관성과 신뢰성을 확보합니다. 이 팀은 QMP(Quality Management Plan)를 작성하고, 이를 기반으로 각 임상감사에 대한 상세 계획을 수립한 후 해당 임상시험 운영의 적절성 여부를 확인합니다. 이러한 점검 과정은 임상시험의 과정, 안전성 및 유효성 데이터, 그리고 관련 문서의 적합성, 규정 준수성, 정확성 등을 검토하기 위해 임상시험 정보, 자료 및 관련 서류의 사내 평가(In-house Audit)와 임상시험 실시기관에 대한 현장 점검(Study On-site Audit), 수집된 정보의 분석과 점검 결과 보고로 이루어집니다. 당사는 이를 통해 임상시험 대상자의 권리와 복지보호, 선행 및 정의의 원칙이 실현됨을 보장하고, 신약 개발 과정에서의 시스템 및 절차를 개선하며 궁극적으로 데이터 품질을 향상시키고자 합니다.
또한, 임상시험과 관련한 협력업체에 대한 전문성, 신뢰성 및 업무 수행 능력을 평가하는 협력업체 자격 평가 및 정기감사 절차를 강화하여 시장승인 보유자 및 임상시험 의뢰자로서의 감독 역할을 보다 능동적으로 수행하고 있습니다.
- 1)GCP(Good Clinical Practice): 임상시험관리기준
- 2)IRB(Institutional Review Board): 임상시험위원회
임상 감사 역량 강화
SK바이오사이언스의 임상 감사 전담조직인 Development QM팀은 국제공인 감사자격증 소지자 및 Global Clinical Trial의 임상품질 업무를 전담하는 전문 인력으로 구성되었습니다. 당사는 핵심 인력에게 국내외 다양한 세미나, 콘퍼런스, 외부 교육 등의 참여 기회를 적극적으로 제공하고 있습니다.
또한, 임상시험관리기준과 관련 법령 및 규제에 대한 높은 이해와 이를 적용할 수 있는 역량을 국제적으로 인정받는 "신뢰성 보증 전문가" 자격 보유자를 지속적으로 확대하여, Global player 수준의 전문역량을 확보하고, 임상 감사의 품질을 강화함으로써 당사의 국제 경쟁력을 높이고자 합니다.
임상시험 품질관리 시스템 개선
최근 제약 및 바이오 산업에서는 위험요소 기반 접근방법(Risk-based approach)을 바탕으로 임상시험 과정 및 데이터에 대한 위험요소를 확인한 후 평가하고 보고하도록 하는 규제가 강화되고 있습니다. 또한, 다국가 연구 및 국내외 파트너사 수 증가, 임상시험 디자인의 복잡성 증대 등의 원인으로 인한 임상시험 품질 보증 및 품질관리의 중요성이 더욱 부각되고 있습니다.
이에 따라 SK바이오사이언스는 임상시험 품질관리의 효율성과 정확도 향상을 위해 임상시험 자료에 대한 품질관리 및 품질보증 활동, 구성원 역량 강화를 위한 교육, SOP 관리 등 체계적이고 지속적인 품질 관리 활동 등을 포함하는 품질관리시스템을 운영하고 있습니다. 해당 시스템은 전자 시스템 형태로 구축되어, 투입되는 시간과 비용을 절감하고 국내외 규제 환경 변화에 더욱 적극적이고 능동적으로 대응할 수 있도록 활용되고 있습니다.
품질경영 및 안전성 관리
품질경영시스템
SK바이오사이언스는 의약품의 개발부터 소비자의 구매에 이르기까지 모든 단계에서 엄격한 품질경영시스템을 운영하고 있습니다. 당사의 품질보증운영체계는 품질이 보증된 의약품을 지속적으로 생산, 관리 및 판매하는 데 최적화된 GMP1) 환경에서 관리되고 있으며, 변경, 일탈, 불만 등의 문제를 시스템적으로 관리하여 우수한 품질의 의약품을 생산하는 데 기여하고 있습니다.
또한, 모든 시설 및 설비에 대한 적격성 평가와 밸리데이션을 실시하여 성능과 기능을 보증합니다. 이처럼 당사는 품질보증, 설비 및 장비, 원자재, 제조 관리, 포장 및 라벨링, 시험관리 등 모든 분야에서 고객과 법적 요구 사항 및 규격을 준수하기 위한 품질정책을 수립하여 운영하고 있습니다. 더불어, 이를 위해 구성원의 교육과 성장을 위한 노력을 병행하며, 품질 우선의 문화를 정착시키기 위해 지속적으로 노력하고 있습니다.
- 1)GMP(Good Manufacturing Practice): 우수제품 제조 및 품질관리 기준
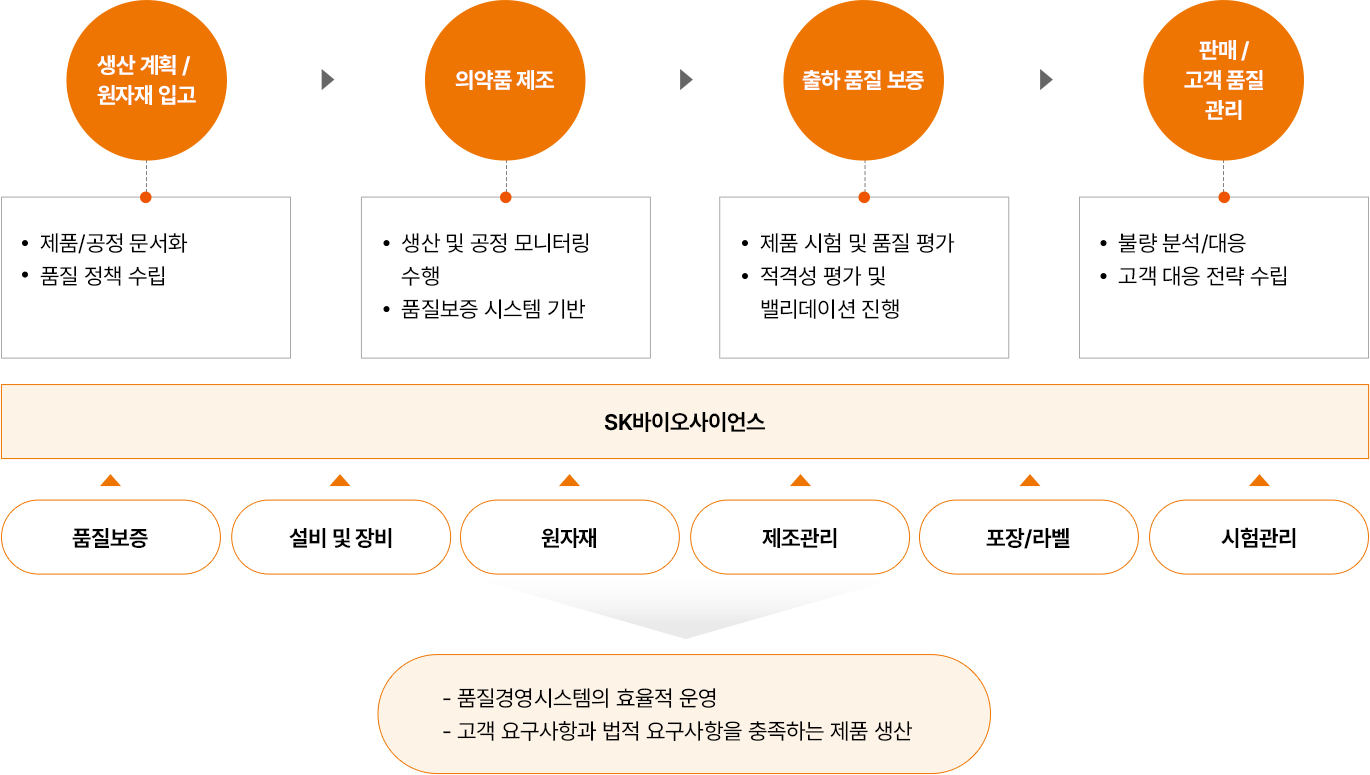
품질시스템(Quality System)
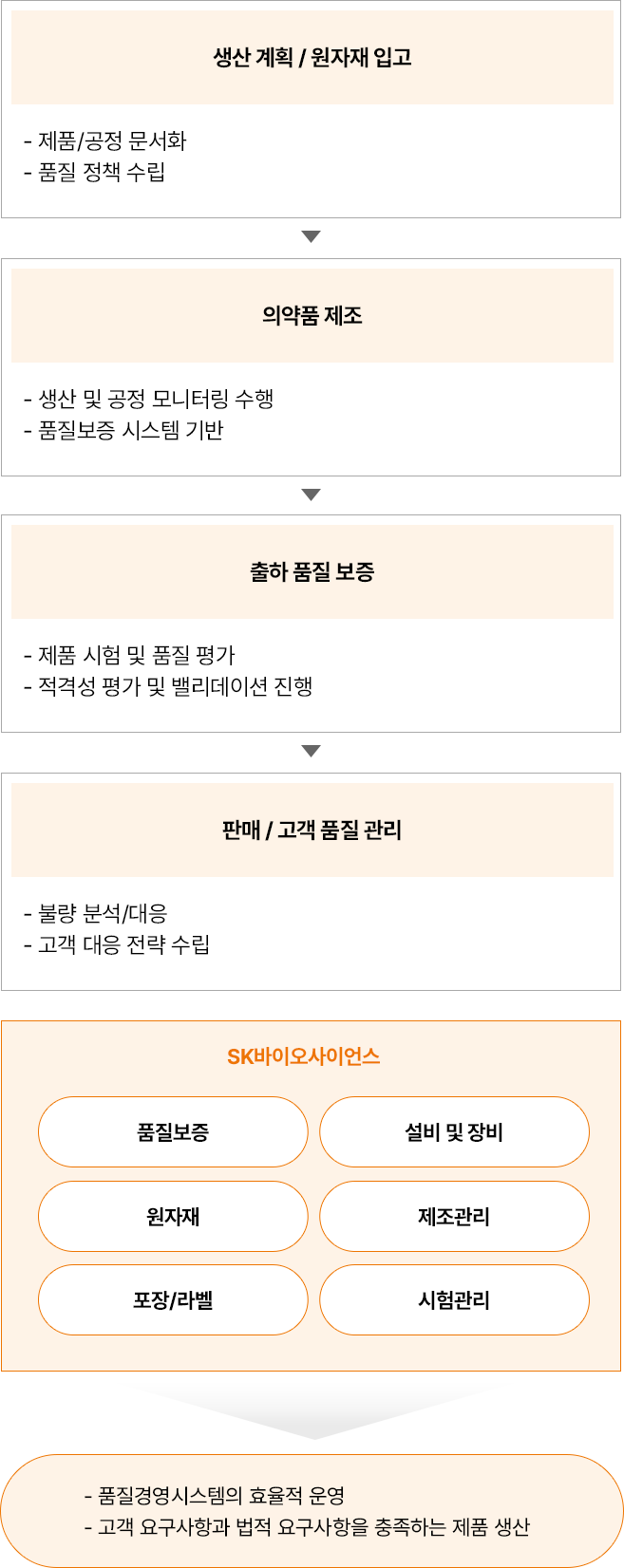
-
- 생산 계획 / 원자재 입고
- 제품/공정 문서화
- 품질 정책 수립
-
- 의약품 제조
- 생산 및 공정 모니터링 수행
- 품질보증 시스템 기반
-
- 출하 품질 보증
- 제품 시험 및 품질 평가
- 저격성 평가 및 밸리데이션 진행
-
- 판매 / 고객 품질
- 불량 분석/대응
- 고객 대응 전략 수립
- SK바이오사이언스
- 품질보증
- 설비 및 장비
- 원자재
- 제조관리
- 포장/라벨
- 시험관리
- 품질경영시스템의 효율적 운영
- 고객 요구사항과 법적 요구 사항을 충족하는 제품 생산
품질경영 추진체계
SK바이오사이언스는 품질보증 시스템 및 GMP를 원활하게 운영하기 위한 체계를 갖추었습니다. QA(Quality Assurance, 품질보증) 부서는 연간 교육 및 공장의 품질교육 시스템을 기반으로 품질 위험관리를 위한 위험분석을 지원하며 일탈처리절차 수행 및 예방조치 시스템을 운영합니다. 또한, GMP 기준에 적합한 설비와 장비의 설치, 교정 및 유지보수를 위한 평가와 모니터링을 수행하며, 제품회수(Recall) 통보/조사/기록 보관, 공급업체 감사 및 구매 변경 승인 등 품질경영 전반의 업무를 수행하고 있습니다.
QC(Quality Control, 품질관리) 부서는 의약품의 제조에 사용되는 원자재, 중간 공정 검체 및 최종 의약품에 대해 표준 운영 절차서(SOP)에 따라 이화학, 미생물학, 동물 시험 및 기기 분석 시험을 진행하여 정해진 규격에 부합하는지 여부를 판정합니다. 이를 위해, 시험법 밸리데이션을 수행하고 기기 적격성 평가, 컴퓨터 시스템 밸리데이션(CSV)2) 등 QC 시험실의 기능을 유지하기 위한 관리활동을 수행하고 있습니다. 당사는 의약품 안정성 평가 프로그램 및 제조 지원 시설에 대한 모니터링을 실시하고 그 결과를 최고경영진에 정기적으로 보고하며 경영진의 피드백을 받아 품질시스템의 지속적인 개선을 위해 최선을 다하고 있습니다.
- 2)CSV(Computer System Validation): 컴퓨터 시스템 밸리데이션
SK바이오사이언스 품질정책(Quality Policy)
- 1품질조직은 생산조직과 독립적으로 운영한다.
- 2GMP를 수행하는 모든 구성원은 적절한 자격을 갖추어야 하며, 교육을 통하여 GMP 수준을 제고하고 유지한다.
- 3모든 중요 제조공정은 밸리데이션되어야 하고, 밸리데이션을 통해 수립된 품질 규격은 정기적으로 검토되어야 하며, 항상 최신의 상태로 유지한다.
- 4규정에서 요구하는 GMP에 필요한 모든 시설과 시스템을 갖춘다.
- 5제조 공정을 진행하는 동안 수행되는 모든 작업은 승인된 방법서에 따라 수행되어야 하며, 모든 진행 내용을 제조지시 및 제조기록서에 기록하고 그 기록을 보존한다.
- 6의약품 회수 시스템을 갖추고 유지한다.
- 7불만처리체계를 갖추어야 하며, 발생한 불만 사항에 대하여 불만의 원인을 조사하고 적절한 조치를 취하여 동일한 사항이 재발하는 것을 방지한다.
품질보증 강화
SK바이오사이언스는 원자재 입고부터 최종 제품 출하에 이르는 의약품 제조 과정을 관리하고 보증하는 품질관리 프로세스를 운영하고 있습니다. 또한, 당사는 품질경영시스템을 구축하여 운영함으로써 고객이 신뢰할 수 있는 제품을 제공합니다. 아울러 당사는 전체 생산 사업장을 대상으로 국내 의약품 제조 및 품질관리기준(K-GMP)을 충족하고 있으며, 해외 시장에서 품목 허가를 획득한 제품별로 유럽의약품청(EMA)의 EU-GMP, 영국 MHRA(의약품 규제당국) 인증, WHO PQ(세계보건기구 사전적격성 평가) 인증을 생산 사업장에 각각 추가 획득함으로써 전체 생산 사업장에서 국내외에서 인정받는 제3자 품질 인증을 확보하였습니다.
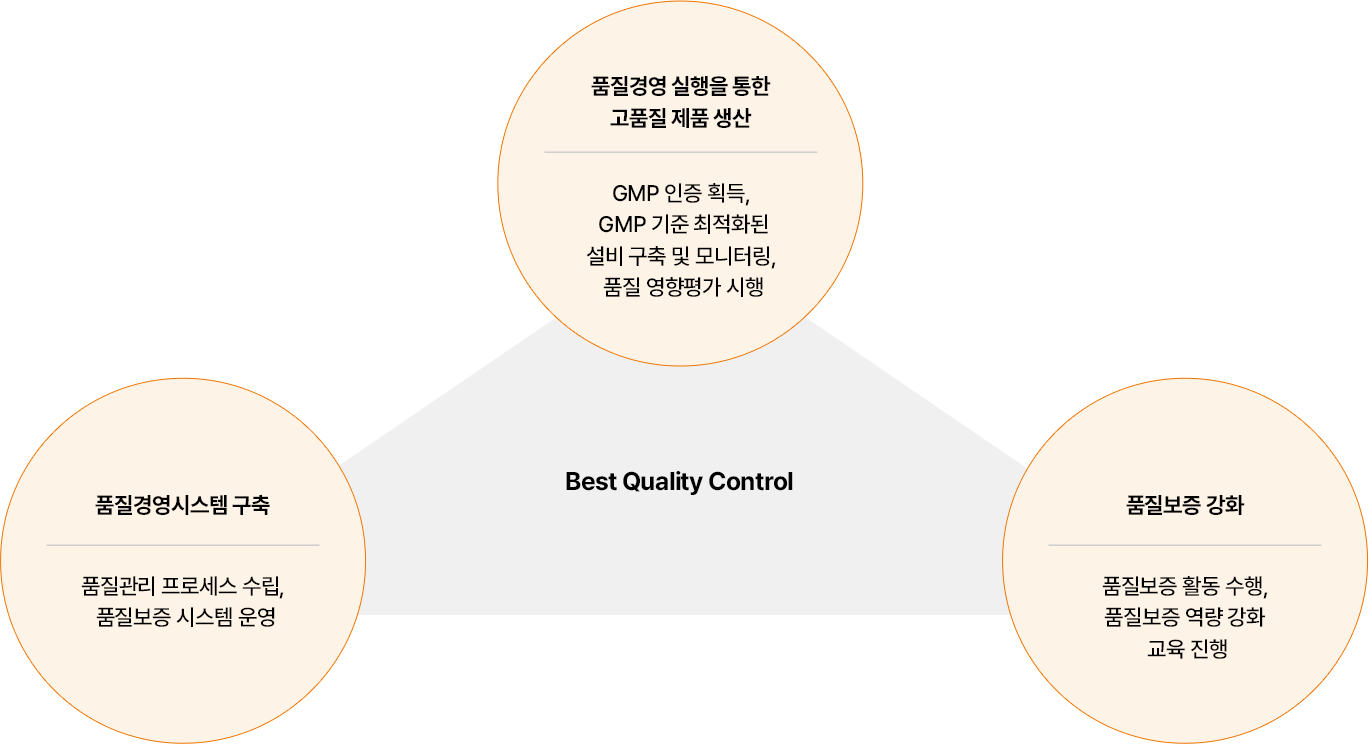
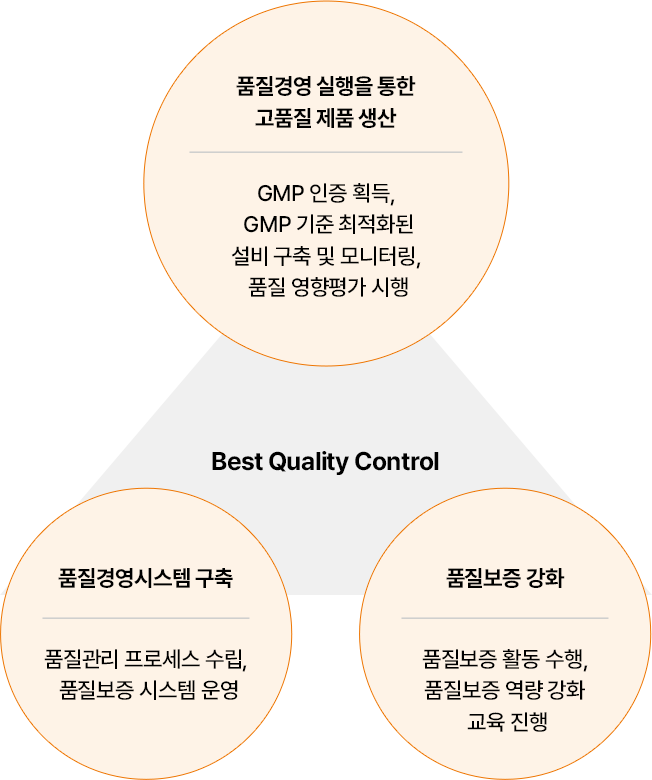
Best Quality Control
- 품질경영 실행을 통한 고품질 제품 생산:GMP 인증 획득, GMP 기준 최적화된 설비 구축 및 모니터링, 품질 영향평가 시행
- 품질경영시스템 구축: 품질관리 프로세스 수립, 품질보증 시스템 운영
- 품질보증 강화:품질보증 활동 수행, 품질보증 역량 강화 교육 진행
품질보증 활동
SK바이오사이언스는 온도와 환경에 민감한 백신 원료의약품 및 완제의약품을 생산하기 때문에 품질 위험 진단 및 관리에 각별한 주의를 기울이고 있습니다. 정해진 온도와 환경에서 제품을 보관하고 모니터링하며, 상용화된 제품은 매년 안정성 시험을 통해 품질을 체크하고 적합한 보관 조건에서 원자재를 관리합니다. 또한, 생산 제품의 GMP 준수 및 공정관리를 위해 제품표준서, 제조기록서 및 절차서를 기반으로 중요한 공정 프로세스를 현장에서 관리·감독하며, 데이터 완전성(Data Integrity) 및 공정 일탈 상황들을 실시간 현장 처리하고자 QA on the shop floor1)를 운영하고 있습니다.
당사는 매년 상반기 생산 제품의 품질영향평가를 통해 품질 이슈의 개선 여부와 글로벌 GMP 수준에 맞는 운영 여부를 지속적으로 관리하고 있습니다. 품질보증 시스템에는 밸리데이션이 완료된 전자품질보증 시스템(eQMS)을 적용하여 일탈, 변경관리, 시정 및 예방, 기준 일탈 등의 관리가 실시간으로 운영되고 추적될 수 있도록 하였습니다.
- 1)품질보증 담당자가 주요 공정에 직접 참여하여 문제 발생 시 즉시 해결 또는 신속한 대응을 하는 시스템으로, 불필요한 공정일탈 상황의 방지 등을 위해 운영함
품질보증 역량 강화
당사는 제품 품질 관리자들을 대상으로 품질보증 역량 강화 교육을 실시하고 있습니다. GMP 역량 강화를 위한 정기 교육을 실시하며, 신규 직원은 기본 교육 및 직무 교육을 통해 해당 직무에 적합한 역량을 갖출 수 있도록 지원하고 있습니다.
품질시험, 무균작업과 같은 특별한 역량이 필요한 직무는 검증과 자격부여 절차를 통해 인증된 작업원만이 해당 작업을 수행하도록 철저하게 관리하고 있습니다. 이에 따라 품질시스템 운영, 생산절차, 위생 및 복장 규정 등의 공통 역량 교육뿐만 아니라 직무별 상세 교육과 구성원들 개개인의 역량을 강화하기 위한 교육 프로그램을 운영하고 있습니다.

GMP 교육 포스터

품질보증 역량 강화 교육 현장
품질 테스트 관리
SK바이오사이언스는 원자재, 반제품 및 최종 제품의 품질 시험은 검증된 시험법, 시험자, 기기를 통해 시험의 신뢰성을 확보 및 관리하고 있습니다. 또한, 제조된 모든 의약품의 품질 및 안전을 보증하기 위해 출하 전에 예방적 차원에서 품질 시험을 진행하고 있습니다. 그 결과는 품질보증 부서에 의해 검토 및 관리되고 있습니다.
시험은 이화학, 바이러스, 미생물, 동물 시험으로 구분하고, 약전(미국약전, 유럽약전, 대한민국약전 등)2) 및 검증된 시험법으로 인증된 시험자가 시험을 실시합니다. 안정성 연구를 위한 별도의 안정성 챔버3)를 갖추고 있으며, 안정성 데이터 수집을 위해 지속적으로 모니터링 하고 있습니다.
- 2)약전: 의약품 품질 관리를 위한 상세한 정보의 모음. 약전은 국가별로 발행하며, 대표 약전으로 미국약전, 유럽약전, 대한민국약전 등이 있음
- 3)안정성 챔버: 안정성 시험을 위하여 온도, 습도, 빛과 같은 다양한 환경 조건을 제공하는 기기
협력사 품질 강화
SK바이오사이언스는 품질경영체계 하에서 협력사의 품질시스템 향상을 위해 공급망 전반에 대한 자체적인 품질 인증 프로그램을 운영하고 있습니다. 모든 1차(Tier 1) 공급업체의 제품 품질과 관련된 제조시설, 생산 프로세스, 시험실, 설비 등에 대해 관련 규정 및 가이드라인에 따라 현장 품질 평가를 수행하고 있으며, 간접 공급업체(Tier 2)의 경우 1차 공급업체의 협력사 관리 시스템 점검과 함께 규제기관의 점검을 통한 체계적 품질관리가 이루어지고 있습니다. 의약 첨가물과 포장재 등 모든 성분/원재료 공급업체(Tier 3)에 대해서는 공급업체 평가와 더불어 정기 품질 검사를 수행하고 있습니다.
당사는 공급업체 리스크 평가 등급에 따라 2~4년 주기의 품질 인증 프로그램을 통해 협력사의 품질시스템 강화를 위한 지속적인 지원 및 모니터링을 수행하고 있습니다. 정기 품질 검사 역시 해당 원자재의 Criticality level(CL)에 따라 다르며, 매 입고 시마다 품질 검사를 진행하고 있고, CL 1등급의 경우 적어도 1년에 1번씩 전 항목의 품질 검사를 실시하고 있습니다.
IDT 품질보증 강화
IDT Biologika(이하 IDT)는 사람 및 동물용 의약품과 백신 등 다양한 제품군에 대해 GMP(우수 제조관리기준) 인증을 보유하고 있으며, 주요 품질 인증에는 EU GMP, 미국 FDA cGMP, WHO PQ, ISO 9001 및 각 국가별 인증이 포함됩니다. 회사는 원료, 출발물질, 중간생성물, 완제의약품, 1차 포장재 등 제조 전 단계에 걸쳐 철저한 품질 시험을 수행하고 있습니다.
IDT의 품질관리 체계는 GMP 관련 가이드라인을 지속적으로 모니터링하고, 새로운 규제 요건을 즉각 반영해 제조 활동 전반이 규정에 부합하도록 관리하고 있습니다. 고객사와의 투명한 협업 또한 규제의 충실한 이행을 위한 핵심 요소입니다.
품질 리스크 관리는 IDT 품질 시스템의 핵심 요소로, 내부 품질 관리절차 전반에 통합되어 운영됩니다. 전문 감사 대응 조직은 고객 및 규제기관의 감사를 체계적으로 지원하고 있으며, 당사의 품질 관리 원칙은 글로벌 기준에 부합하도록 보편적으로 적용되는 동시에, 국가별 요구사항에 따라 유연하게 조정됩니다. 특히, 유럽 내 품질관리책임자(QP)에 의한 제품 출하 및 미국 내 품질보증 출하(QA Release)를 위한 지원 체계를 갖추고 있습니다.
약물감시 (PV, Pharmacovigilance)
약물감시 시스템
SK바이오사이언스는 의약품의 전 주기에 걸친 약물감시(PV, Pharmacovigilance) 절차를 마련하여 시행하고 있습니다.
의약품 개발 단계인 비임상시험과 임상시험부터 안전성 정보를 수집하여 평가와 분석을 수행하고 있으며, 이 결과를 토대로 제품의 중요한 위해성을 확인해 시판 후 위해성 관리 계획을 수립하고 있습니다.
시판 후에는 사전에 수립한 위해성 관리 계획을 기반으로, 개발 단계에서 미처 파악하지 못했던 안전성 정보를 확인하기 위해 의약 전문가와 접종자 등으로부터 이상사례 정보를 지속적으로 수집합니다. 수집된 정보는 당사의 안전성 데이터베이스에 체계적으로 축적되며, 이를 바탕으로 제품의 위해성-유익성 평가를 진행합니다. 또한, 평가 결과를 토대로 제품 첨부문서, 의약사 및 전문가용 설명 자료, 환자용 사용 설명서 등에 반영하여 위해성 완화 조치를 마련하고, 예상되는 위해성을 최소화할 수 있도록 선제적이고 철저한 안전 관리를 시행하고 있습니다.
약물감시 교육
SK바이오사이언스의 모든 구성원들은 매년 최소 1회 약물감시 교육을 받습니다. 이는 당사가 생산 및 판매하는 제품의 안전 관리를 철저히 하기 위한 조치의 일환으로, 신규 입사자는 입사 후 1개월 이내에 교육을 이수해야 하며, 재직 구성원들은 매년 정기적으로 약물감시 교육을 이수합니다. 특히, 제품 판매 업무를 담당하여 의사 등 전문가로부터 이상 사례 발생 사실을 접할 가능성이 높은 마케팅 조직 구성원들에 대해서는 추가적인 대면 교육을 실시하고 있습니다.
약물감시 활동
SK바이오사이언스는 글로벌 규제기관의 약물감시 요구 조건을 충족하기 위해 약물감시 시스템을 고도화하고 있습니다. 구성원들이 좀 더 쉽고 빠르게 우리 제품의 안전성 정보를 담당 부서에 보고할 수 있도록 사내 안전성 정보 보고 시스템(SIRS)1)을 구축하여 운영하고 있으며, 이렇게 수집된 정보를 국제 기준에 맞게 관리할 수 있는 안전성 데이터베이스(Safety DB)를 구축해 운영하고 있습니다.
또한, 약물감시 활동의 전문성을 강화할 수 있는 조직 구조를 마련하여 업무를 수행하고 있으며, 각 조직의 역할에 따라 약물 위해성 관리 계획 및 위해성 완화 조치 수립, 그리고 수집된 안전성 정보를 바탕으로 한 위해성-유익성 평가 업무를 진행하고 있습니다. 이러한 업무의 세분화 및 전문화를 통해 약물감시(PV) 업무를 지속적으로 고도화하기 위해 노력하고 있습니다.
이와 더불어 당사의 제품을 도입한 고객사들과 별도의 안전성 정보 교환 계약(Safety Data Exchange Agreement)을 체결하여 계약 지역에서의 제품의 안전성 정보를 수집하고, 계약 지역 내에서 필요한 위해성 완화 조치들을 마련하여 운영하고 있습니다.
- 1)SIRS(Safety Internal Reporting System): 안전성 정보 보고 시스템
약물감시 체계 및 시스템 개선
SK바이오사이언스는 약물감시 시스템 고도화를 위해 다음의 활동을 수행하고 있습니다.
01. 약물감시 시스템 고도화
2019년부터 약물감시 시스템 마스터 파일(PSMF)2)를 구축하여 운영 중이며 매년 업데이트를 하고 있습니다. PSMF는 국내에서 아직 법제화되지 않았지만, 당사는 PSMF 구축하여 PV 업무 시스템 전반의 수준 향상을 위해 노력해오고 있으며, 유럽의약품청(EMA) 등 선진 규제 기관의 요구 수준을 업무에 반영하기 위해 노력하고 있습니다. 표준 운영 절차서(SOP) 또한 이러한 기조에 맞추어 구축 및 운영하고 있습니다.
02. Safety Signal Detection 절차 운영
2023년 5월부터 제품 안전성 데이터를 주기적으로 검토하여 의약품의 안전성 실마리 정보(Safety Signal)를 탐지하는 업무 절차를 구축해 운영하고 있습니다. 당사에서 수집한 데이터 뿐만 아니라 한국의약품안전관리원에서 수집한 원시자료 또한 활용해 분석하고 있으며 이를 통해 예상하지 못한 위해성 및 불규칙성을 모니터링하고 있습니다.
03. 내부 감사 및 파트너사 감사를 통한 약물감시 시스템 개선
2023년부터 약물감시 시스템 내부 감사, 2024년부터 파트너사 대상 약물감시 시스템 감사를 시작하였습니다. 주기적인 약물감시 감사를 통해 당사 뿐만 아니라 파트너사 또한 관련 규정에 따라 약물감시 업무 시스템이 운영되는지 확인하고, 효율적이고 체계적으로 업무를 수행할 수 있도록 세부 업무 시스템을 점검하고 있습니다. 점검 이후에는 점검 결과를 바탕으로 조치 사항을 마련해 업무 절차를 개선하고 있으며, 이를 바탕으로 당사 및 파트너사 모두 제품 안전성 관리 수준을 계속해서 높여 나갈 수 있도록 노력하고 있습니다.
- 2)PSMF(Pharmacovigilance Systems Master File): 약물감시 시스템 마스터 파일
항생제 내성(AMR: Antimicrobial Resistance)
SK바이오사이언스는 자체개발 백신을 생산 및 판매해 온 기업으로서 항생제 내성 심화가 중대한 글로벌 공중보건 리스크라는 점을 인식하고 있습니다. 세계보건기구(WHO)에 따르면, 항생제 내성은 인류가 직면한 10대 글로벌 공중보건 위기에 해당합니다. 내성으로 인해 항생제(항생물질, 항바이러스제, 항진균제 등)의 효과가 사라져 감염에 의한 질병 확산, 중증질환 및 장애, 사망 위험 등이 높아지기 때문입니다.
또한, 항생제 내성 문제는 글로벌 발전에 위협 요인으로도 지목되고 있습니다. 항생제 내성의 가장 큰 원인은 인간, 동물, 식물을 대상으로 한 항생제 오남용이며, 전 세계적으로 발생하는 현상이지만 보건의료 인프라가 취약한 저개발국에서 더욱 심각하게 나타나며 환자에게 막대한 경제적 비용을 유발하고 있습니다.
백신 접종을 통한 질병 감염 예방은 항생제 오남용을 줄일 수 있는 방법의 하나로 알려져 있습니다. 당사는 유효성과 안전성을 갖춘 백신을 개발 및 판매하여 인류를 질병으로부터 보호하고자 하며, 백신 생산 역량이 부족한 해외 지역에 글로컬라이제이션 전략을 추진하여 글로벌 백신 보급 불균형 해소 및 항생제 내성으로 인한 공중보건 리스크 완화에 간접적으로 기여하고자 합니다.
책임 있는 마케팅
책임 있는 마케팅 정책
마케팅 컴플라이언스 준수
SK바이오사이언스는 약사법, 의료법, 공정거래법, 공정경쟁규약 등 관련 법 규정을 준수하며 책임 있는 마케팅을 실시합니다. 이를 위해 당사는 컴플라이언스 규정을 제정하고 보건의료전문가 대상의 경제적 이익 제공에 대한 세부적인 가이드를 마련하여 운영하고 있습니다.
특히, 2023년에는 공정거래 관련 법규 및 약사법, 공정경쟁규약 등에 대한 구성원의 이해와 실천을 제고하고 마케팅 활동에서의 투명성, 공정성을 확보하기 위해 공정거래의 기본 원칙과 가이드를 담은 공정거래 자율준수 편람을 발간하여 전 구성원에게 배포하였습니다.
또한 공정거래 관련 법규를 준수하고, 홍보 및 광고 관련 활동을 엄격히 규제함으로써 소비자를 보호하고 산업 내 공정한 경쟁 환경을 조성하는 데 기여하고 있습니다. 특히 허위/과장 광고를 방지하기 위해 기본 원칙 및 의약품의 광고 범위를 명시하고, 의약외품 광고 시 세부 준수 사항을 수립하여 제품 오용의 가능성을 최소화하고자 합니다.
당사 마케팅 조직에서 활용하는 홍보물을 제작할 때에는 RED 시스템이라는 내부 검토 프로세스를 진행하여 의학, 허가 사항, 법률적 관점에서 위반 사항이 없는지 교차 점검하고, 오프라벨(Off-label)1) 처방을 유도할 수 있는 어떤 종류의 마케팅이나 프로모션도 진행하지 않습니다.
- 1)Off-label: 허가 외 사용의약품
책임 있는 마케팅을 위한 상시 모니터링
SK바이오사이언스는 마케팅 판촉활동에 대한 상시 모니터링을 진행하고 판매 협력사로부터 공정거래협약서를 수취함으로써 판매 협력사가 공정거래에 동참할 수 있도록 합니다.
마케팅 활동의 컴플라이언스 규정 준수를 사전에 점검하기 위해 비용 품의 시에는 컴플라이언스 부서와 반드시 합의를 거쳐야 합니다. 또한, 지출 후에도 내역 보고서를 즉각 모니터링하여 공정경쟁규약 준수 여부를 점검하고 신속한 피드백을 통해 마케팅 활동을 지원하고 있습니다.
모니터링 과정에서 위반 사항이 적발되면 위반 점수를 부여하고 그 결과를 조직 및 개인의 KPI에 반영함으로써 책임있는 마케팅 활동을 독려하고 있습니다. 중대 위반의 경우 컴플라이언스 규정 제14조(임직원에 대한 제재)에 의거한 징계 절차를 취하며, 그 결과는 구성원에게 모두 공개합니다.
발견된 위반 사례의 원인과 결과를 분석하여 시사점을 컴플라이언스 교육에 반영함으로써 동일 사례의 재발을 예방하고 실질적인 교훈도 제공하고 있습니다.
마케팅 판촉활동 상시 모니터링 프로세스
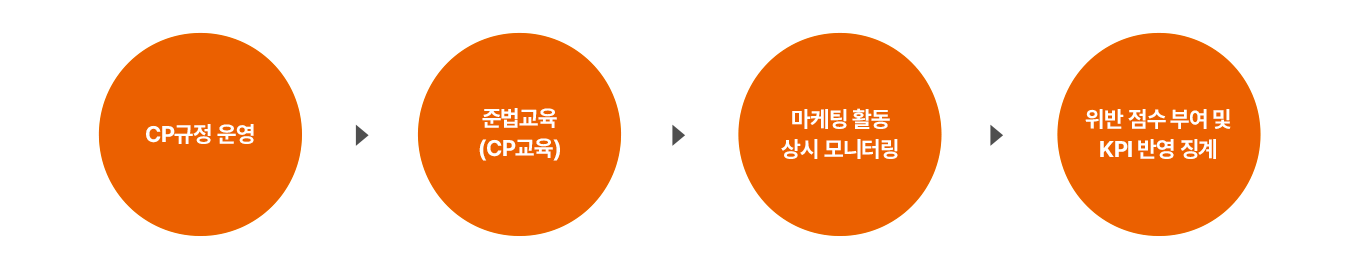
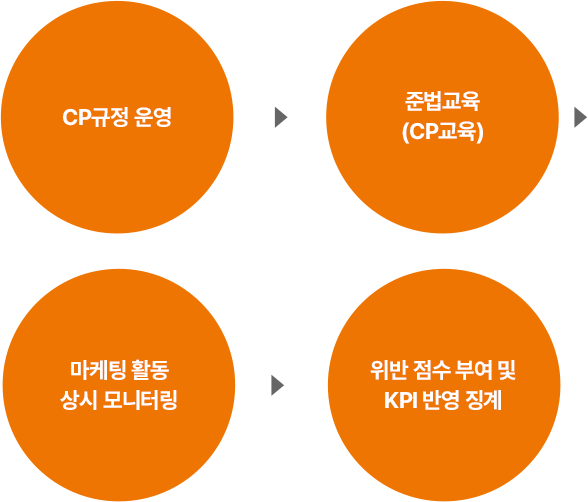
- CP규정 운영
- 준법교육 (CP교육)
- 마케팅 활동 상시 모니터링
- 위반 점수 부여 및 KPI 반영 징계
마케팅 활동의 CP규정 준수 점검
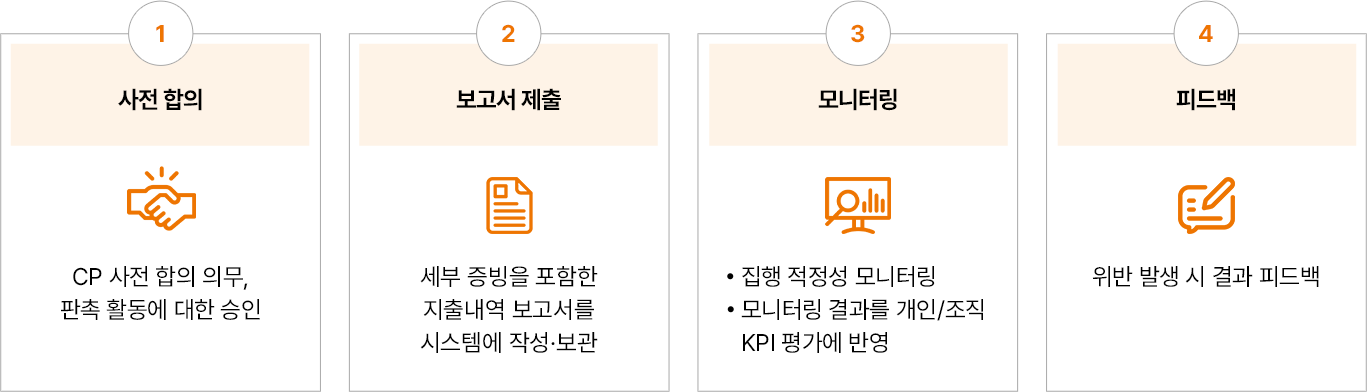
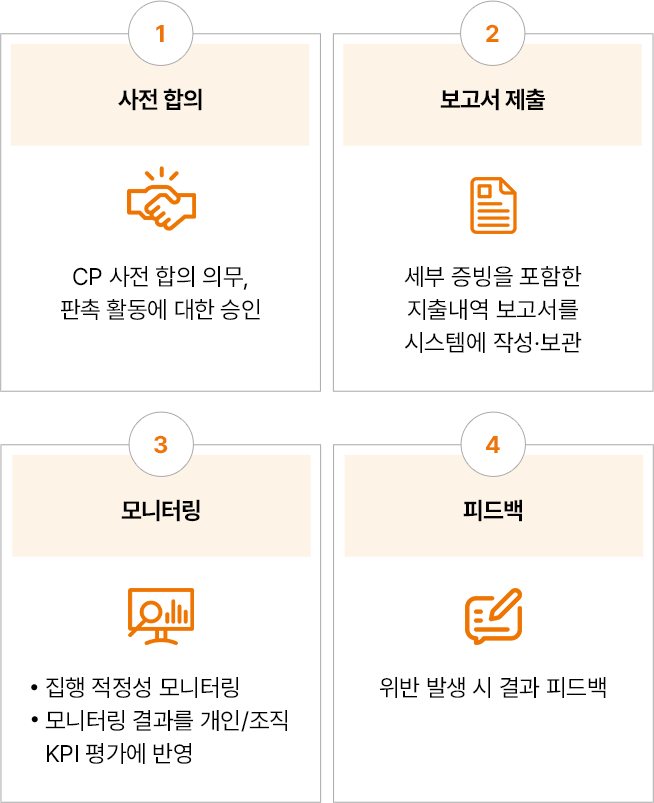
- 사전 합의:CP 사전 합의 의무, 판촉 활동에 대한 승인
- 보고서 제출:세부 증빙을 포함한 지출내역 보고서를 시스템에 작성·보관
- 모니터링:집행 적정성 모니터링, 모니터링 결과를 개인/조직 KPI 평가에 반영
- 피드백:위반 발생 시 결과 피드백
마케팅 컴플라이언스 교육
SK바이오사이언스는 유관부서 대상으로 책임 있는 마케팅에 대한 회사의 방침을 숙지할 수 있도록 매년 교육을 실시합니다. 약사법, 공정거래법, 공정거래규약 준수, 지출결의서 작성, 디지털 마케팅 등 마케팅 활동에서 주의해야 할 컴플라이언스 규정에 대해 자세히 교육함으로써 공정한 의약품 유통 질서를 확립하고자 노력하고 있습니다.
2024년 마케팅 교육 현황
| 교육내용 | 교육대상 | 일시 |
|---|---|---|
| 마케팅 CP교육 (CP규정, CP KPI 기준, 약사법, 공정경쟁규약, CP위반사례 등) | 마케팅실 | 상반기: 2024년 1월 19일 하반기: 2024년 8월 27일 |
| 공정거래 교육 | 마케팅실 | 2024년 1월 19일 |
고객 만족 전략
SK바이오사이언스 고객 만족 비전 및 전략
비전
회사는 고객을 지속적으로 만족시켜 고객으로부터 신뢰를 얻어야 하며, 궁극적으로 고객과 더불어 발전해야 한다.
전략
- 인허가부터 판매까지 일원화된 시스템
- 공공 및 민간 시장 각각에 특성화된 전략
- 영유아, 소아청소년, 성인 전 연령층을 아우르는 포트폴리오
SK바이오사이언스 고객 분류
SK바이오사이언스는 공공/민간 및 국내/해외 시장에 따라 고객을 구분하여 관리합니다.


- 연구개발부터 상업화까지 진행한 자체개발 백신(SKYVAX)의 국내 영업, 타사 상품 도입 및 국내 유통판매의 경우 당사의 마케팅 조직에서 고객사 커뮤니케이션을 담당함
- 해외 코로나19 백신의 C(D)MO 계약 체결 및 자체 개발 백신(SKYVAX)의 해외 수출의 경우 국제기구 및 정부 입찰 계약을 통해 제품이 공급되므로 각 프로젝트 및 계약 담당자가 고객을 관리함
제품 정보 제공 및 상담
SK바이오사이언스는 고객 상담실을 운영하여 일반 병·의원을 통해 유통되는 자사 백신 제품에 대한 소비자 문의에 신속하고 전문적으로 대응하고 있습니다.전문 상담 인력이 이상반응, 제품 구입 등 다양한 고객 문의에 신속하게 응답함으로써 소비자의 불안과 불편을 최소화하고 있습니다. 또한, 당사는 백신 유통 전반에 걸쳐 품질 관리, 안전성 확보, 정확한 정보 제공, 콜드체인(Cold Chain) 유지 등을 최우선으로 관리하고 있으며, 허가 단계에서 확보한 안정성 정보를 포함한 주요 사항을 고객에게 투명하게 전달하고 있습니다. 향후에도 SK바이오사이언스는 제품의 우수한 품질, 안전성 및 효과를 중심으로 고객과의 신뢰를 강화하고, 고객 만족을 제고하는 마케팅 전략을 지속적으로 전개해 나갈 계획입니다.

고객 대상 제품 정보 제공 사례(스카이바리셀라 설명서)
이상사례 수집
SK바이오사이언스는 고객 상담실을 통해 의약전문가 및 제품 사용자로부터 확인된 이상 사례를 수집하고 있습니다. 수집된 정보는 당사의 안전성 정보 보고 시스템을 통해 약물감시(PV) 전담 조직으로 전달되며, 필요한 경우 추가적인 정보 확보를 위한 후속 조치 및 조사를 진행하고 있습니다.
고객사 커뮤니케이션
SK바이오사이언스는 국내 고객사와 다양한 채널을 통해 적극적으로 커뮤니케이션하고 있습니다. 당사의 고객은 주요 고객사 및 일반 소비자, 그리고 도입 상품을 들여오는 외국계 제약사나 당사의 제품을 공동으로 판매할 권한을 부여받은 파트너사 등을 포함합니다. 당사는 백신사업 확장 및 신규 사업 추진 시 필수적인 고객사, 규제 기관과의 활발한 교류를 위해 수도권 및 지방에 각각 거점을 두고 있습니다.
SK바이오사이언스는 주요 이해관계자와의 활발한 커뮤니케이션을 위해 운영위원회(Steering Committee)와 실무자 주도의 대면 및 비대면 회의를 진행합니다. 각 고객사와 당사가 맺은 계약에 따라 각 사의 임원, 실무진 등이 모여 주기적으로 진행하는 회의에서는 제품별 주요 마케팅 계획이나 분기별/월별, 연간 계획 등을 논의하고 있습니다.
